명연, 이승환·김선욱 박사팀과 이동석 경북대 교수팀 공동연구로 성과
염기서열 말단을 DNA로 치환, 표적 유전자 인식 특이성 높여
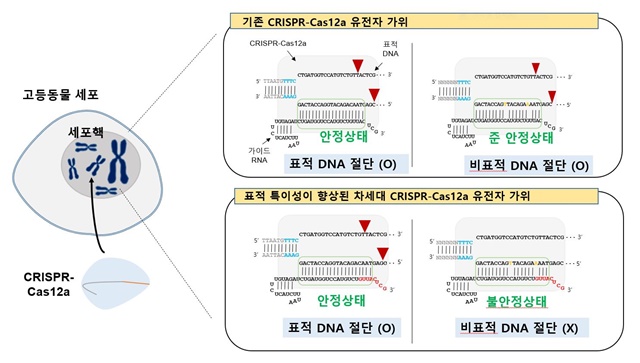
한국생명공학연구원(원장 김장성)은 이승환 국가영장류센터 박사팀과 김선욱 미래형동물자원센터 박사팀, 이동석 경북대 교수팀이 기존 CRISPR-Cas12a 유전자 가위의 표적 인식 특이성을 극대화할 수 있는 기술을 개발했다고 2일 밝혔다.
유전자가위로 불리는 CRISPR-Cas12a 시스템은 박테리아, 고세균에서 발견되는 면역체계의 일종이다. Cas단백질과 표적 DNA에 결합해 이중 나선 절단을 유도하는 것으로 알려져 있다. 생명체 유전체 교정에 보편적으로 사용된다.
CRISPR-Cas12a 유전자 가위는 CRISPR-Cas9과는 다른 종류의 염기서열을 인식해 상보적으로 사용되고 있다. 그러나 특정 유전자를 의도치 않게 절단해 유전자 치료제로 인체 적용 시 보완점으로 지적돼 왔다.
연구팀은 CRISPR-Cas12a유전자 가위의 표적 특이성을 높였다. CRISPR-Cas12a의 구성물 중 특정 염기서열 말단을 DNA로 치환해 표적 오류를 획기적으로 줄이는 방법을 개발했다. 연구팀은 실험을 통해 CRISPR-Cas12a 유전자 가위 사용시 다양한 유전자 타겟에서 표적 특이성이 크게 증가함을 확인했다.
연구책임자인 이승환 박사는 "유전자 가위의 표적 특이성이 CRISPR 유전자 가위 구성물의 특정 염기서열 말단을 DNA로 치환하는 방법을 통해 혁신적으로 증가될 수 있다는 사실을 밝힌 것"이라며 "개발된 방법은 가이드 RNA를 근간으로 작동하는 다양한 유전자 가위 시스템에 적용될 수 있고, 효율적 암 치료제뿐만 아니라 다양한 유전 질환, 희귀성 난치 질환 등의 유전자 치료제 개발에 있어서 안전성 향상 면에서 큰 기여를 할 것으로 기대된다"고 말했다.
한편 이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 신진연구자지원사업, 국가과학기술연구회가 진행하는 BIG(Big Issue Group) 사업의 지원을 받았다. 결과는 생물학 분야 국제 저널인 핵산 연구((Nucleic Acids Research)에 7월 21일 온라인 게재됐다. 연구에는 교신저자 이승환박사, 김선욱 박사, 이동석 교수, 공동 제1저자는 김한섭 박사과정, 이위재 석사과정 학생이 참여했다.
◆ 용어설명
▲CRISPR-Cas12a(Cpf1): 박테리아 및 고세균에서 분리된 바이러스 대응 면역체계중 하나의 시스템. CRISPR-Cas9과 병행해 T-rich 영역을 인식, 타겟팅할 때 사용하는 보편화된 유전자 가위 시스템.
▲가이드 RNA(guide RNA): CRISPR-Cas12a에 해당해 crRNA 라고도 한다. 기본적으로 타겟에 상보적으로 결합하는 protospacer 부분과, 보존된 구조를 이루는 direct repeat 영역으로 나누어짐. Protospacer 부분을 타겟팅하는 유전자마다 상보적으로 결합할 수 있도록 바꿔주면 CRISPR-Cas12a를 원하는 유전자 염기서열에서 작동시켜 이중 나선 절단을 유도할 수 있다.
▲표적 특이성(target specificity): CRISPR 유전자 가위 작동시, 비표적 염기서열 작동 대비 표적 염기서열에 작동하는 비율. 비표적 염기서열 오작동이 줄고, 표적 염기서열 작동이 늘어나면 표적 특이성이 향상되었다고 나타냄.
댓글 정렬