임용택 성균관대 교수 연구팀, 생체이식형 전달체 개발
화학항암제와 면역제어물질 탑재, 항암효율 높여
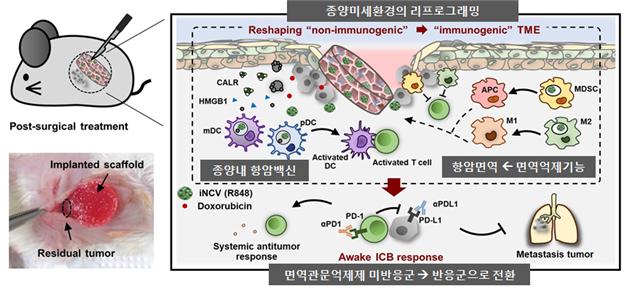
한국연구재단(이사장 노정혜)은 임용택 성균관대학교 교수 연구팀이 화학항암제와 면역제어물질을 탑재한 생체이식형 전달체를 제작하고 생쥐 모델에서 항암효율을 높였다고 13일 밝혔다.
연구팀은 종양 부위에 필요한 만큼의 항암제를 전달하는 것과 병행해 면역활성화를 유도하는 이식형 약물전달체도 제안했다.
종양세포 주변에는 암의 성장을 억제하는 면역세포, 성장과 전이를 촉진하는 면역세포가 공존한다. 때문에 면역관문억제제와 같은 면역항암제는 일부 암 또는 환자에게서만 효과를 보여 면역제어물질과 병행연구가 활발하다.
연구팀은 향후 임상적용 가능성을 고려해 히알루론산과 콜라겐 등 생체적합성 소재로 지름 5~10mm 크기의 알약 모양 전달체를 제작했다. 여기에 화학항암제 독소루비신과 면역제어물질(일명 나노면역컨버터)을 담아 암 세포 주변의 종양미세환경에 이식했다. 종양미세환경을 변화시켜 면역관문억제제의 효과를 높이고자 했다.
그 결과 면역관문억제제에 반응하지 않던 유방암과 자궁경부암 생쥐모델에서 암세포의 성장이 억제되는 것을 확인했다. 종양 제거수술 후 재발이나 전이에도 영향을 미쳤다. 전달체가 이식된 생쥐는 55일 이후에도 7마리가 생존했다. 반면 약물을 투여하지 않거나 면역항암제만 투여한 생쥐는 한달 가량 후 모두 사망(10마리) 했다.
나노면역컨버터는 암세포의 존재를 인지하는 능력을 가진 항원제시세포와 암세포를 살상하는 능력을 가진 T세포를 종양세포 주위에 집결시킨다. 또 면역억제인자를 제거해 면역항암제가 최적의 효능을 발휘할 수 있는 환경을 만들어 주는 역할하며 항암 효율을 높였다.
앞으로 연구진은 환자마다 다른 종양미세환경에 맞는 면역억제인자를 분석해 환자 맞춤형 약물을 탑재할 수 있는 항암면역 연구를 지속할 계획이다.
연구팀은 "핵심은 전신독성 문제로 임상사용에 제한이 있었던 저분자 레시퀴모드(Resiquimod)를 서방형 고분자 나노입자 내에 넣어 해결했다는 것"이라면서 "이를 통해 암세포의 존재를 알리는 항원제시세포와 종양사멸 대식세포로 바꾸는 나노면역컨버터를 개발 한것"이라고 설명했다.
이번 연구는 과학기술정보통신부와 한국연구재단이 추진하는 기초연구사업(중견연구) 지원으로 수행됐다. 성과는 소재 분야 국제학술지 어드밴스드 머티리얼즈에 지난달 6일 게재됐다.
댓글 정렬