김상규 교수 연구팀, 피코초 분광법 이용해 화학반응 교차점서 두 반응 속도 측정
연구 논문 '미국화학회지' 7일 자 게재
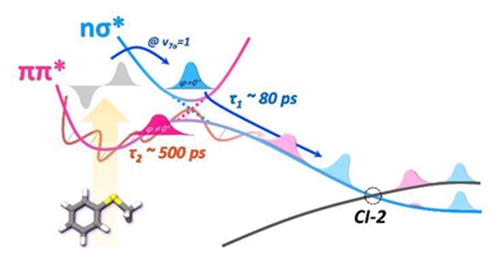
빛을 받아 일어나는 화학반응은 전자적으로 들뜬 상태에서 상호작용으로 발생한다. 보통 전자상태 간 상호작용은 경로 한 개를 갖지만 양자상태에 따라 반응속도가 변하는 현상이 종종 발견된다. 이처럼 두 개 이상의 다른 성격을 지닌 위치에너지 곡면들이 교차하는 지점을 원뿔형 교차점(conical intersection)이라 한다.
김 교수는 2010년 분광학적 방법으로 원뿔형 교차점을 발견했고 그것이 양자상태 반응의 시작점임을 증명했다. 또 여기서 출발한 반응은 다른 반응속도와 경로로 진행된다는 것도 밝혔다. 하지만 일반적인 분광법으로 각 곡면이 갖는 속도는 측정하지 못했다.
연구팀은 기존의 나노초(10-9초) 기반으로 한 분광법 대신 피코초(10-12초) 시간분해능 분광법을 이용해 에너지와 시간 모두 정확히 측정했다. 이를 통해 단열 반응(adiabatic reaction)과 비단열 반응(non-adiabatic reaction) 각각 두 개의 경로가 활성화됨을 알아냈고 반응 속도뿐 아니라 생성물의 에너지 분포 등이 큰 차이를 보임을 확인했다.
김 교수는 "기초과학의 발전 없이 새로운 기술적 진보는 기대하기 힘들다"며 "이번 연구로 기초과학 연구에 열정을 다하는 젊은 기대주들이 성장할 수 있길 바란다"고 전했다.
한편, 이번 연구 논문은 '미국화학회지(JACS)' 7일 자에 온라인 게재됐다.
정정은 인턴 기자
bill9514@hellodd.com
댓글 정렬