엄수현 GIST 교수팀, 신규 세포 골격조절 단백질 3차원 구조 확인
한국연구재단(이사장 조무제)은 엄수현 GIST(광주과학기술원) 교수 연구팀이 신규 세포 골격조절 단백질(EFhd2)의 고해상도 3차원 구조를 밝혀내고 작용 메커니즘을 규명하는데 성공했다고 15일 밝혔다.
EFhd2 단백질은 세포 가장자리 운동성 돌기 부분에 집중적으로 발현되는 신규 세포 골격 단백질로 칼슘과 결합하는 특성이 있다.
칼슘과 결합된 EFhd2 단백질은 안정된 구조를 가지며 가닥가닥 흩어진 액틴을 다발로 묶게 된다. 그러면서 세포를 안정되게 하고 이동을 원활하게 돕는 역할을 하게 된다.
하지만 암세포 안에서 EFhd2 단백질이 과하게 발현되면 세포 이동속도가 증가하면서 암세포 전이에 영향을 미치는 것으로 알려져 항암제 개발의 표적단백질로 주목돼 왔다. 그동안 EFhd2 단백질의 3차원 구조와 작용 메커니즘은 알려지지 않아 작용기전을 설명하는데 한계가 있었다.
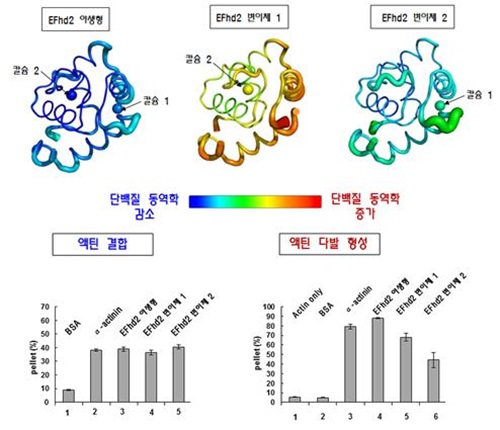
연구팀은 X선 회절 정보를 이용해 몸 안의 EFhd2 단백질에 칼슘이 결합된 구조와 결합하지 않은 3차원 구조를 밝혀냈다.
그 결과 세포골격 유지에 필요한 섬유단백질인 액틴결합 부위에 칼슘 결합에 필수적인 EF-hand 도메인이 포함돼 있음을 확인했다. 여기에 칼슘이 결합되면 액틴 결합부위 구조도 안정화되고 액틴다발 형성 기능도 향상된다.
반면 EF-hand 도메인에 칼슘이 결합되지 않으면 액틴 결합부위가 역동적인 구조로 변화되고 액틴다발 형성도 감소했다. 액틴 다발 형성이 감소할 경우 정상인은 세포 유지와 이동에 영향을 받지만 암세포 속의 EFhd2 단백질에서 액틴다발이 감소하면 암세포 전이도 약화시킬 수 있다는 게 연구팀의 설명이다.
엄수현 교수는 "이번 성과는 세포 생존 조절에 관여하는 EFhd2의 칼슘 결합 여부에 따른 액틴다발형성 조절 메커니즘을 처음으로 밝힌 것"이라면서 "이번 성과로 암세포 전이를 막는 항암제 개발, 알츠하이머, 치매 등 다양한 신경퇴행성 질환 치료제 개발에 기여할 것으로 기대된다"고 연구의의를 설명했다.
한편 이번 연구는 미래창조과학부와 한국연구재단의 기초연구사업(개인연구), 바이오의료기술개발사업, 방사선기술개발사업의 지원으로 수행됐다. 결과는 국제적인 학술지 네이처(Nature) 자매지인 사이언티픽 리포츠(Scientific Reports)에 12월 15일자에 게재됐다.
댓글 정렬